歡迎您訪問愛非克(深圳)生物科技有限公司
關鍵詞:AKK菌
炎癥性腸病(IBD)目前已成為一個全球性的疾病。
炎癥性腸病(IBD)包括潰瘍性結腸炎(UC)和克羅恩病(CD),在過去20年中隨著發病率迅速增加它已成為全球負擔。WTO將每年的5月19日定為炎癥性腸病日,它曾被認為是“西方人的疾病”,以往在我國患病率很低,但近年來患病率呈現增加趨勢,目前全球約有500多萬炎癥性腸病患者。
研究背景
研究發現在IBD患者中觀察到高頻率的心理障礙,例如抑郁或焦慮,抑郁癥會影響IBD的嚴重程度,包括生活質量降低、住院、手術風險和IBD發作。心理障礙會導致腸道微生物群失調和結腸黏膜屏障損傷,從而增加患IBD的風險。
然而,心理障礙或抑郁癥在IBD惡化中的作用背后的機制尚未得到充分探索。最新的證據表明,抑郁癥加重IBD的危險因素與腦-腸軸密切相關,腦-腸軸被認為是大腦和腸道相互作用的雙向聯系,腸道被認為是顯著影響大腦功能和結構的生物因素之一,而大腦也調節腸道微生物群和微環境,因此,篩選特定的腸道微生物在探索新的治療選擇方面起著重要作用。
結腸粘液被認為是有效保護結腸免受毒素和病原微生物入侵的第一道物理屏障,由廣泛糖基化的粘蛋白2(MUC2)產生和維持,該粘蛋白由杯狀細胞分泌,大約每小時更新一次內部粘液層。據報道,慢性應激引起的腸道通透性增強和腸道微生物群失調會導致粘膜免疫反應和腸道炎癥。然而,腸道微生物群及其對腦-腸軸內結腸粘液的影響之間的關系值得進一步研究。該研究通過慢性束縛應激(CRS)建立小鼠抑郁模型,來研究CRS對葡聚糖硫酸鈉(DSS)誘導的結腸炎的影響。此外,還進行腸道微生物群移植實驗以研究腸道微生物群與結腸黏膜屏障之間的因果關系。
研究內容
實驗1:慢性約束應激和葡聚糖硫酸鈉誘導的結腸炎方案
32只小鼠被隨機分配到四組:常規飼養(CB;n=8)、CRS(n=8)、葡聚糖硫酸鈉(DSS;n=8)和DSS+CRS(n=8)。CRS和DSS+CRS組的小鼠連續30天被限制在50 ml通風良好的離心管中,3小時/天(上午9:00至12:00),期間不允許在手術過程中前后移動。30天后進行行為測試(露天試驗、尾懸試驗、強迫游泳測試)以評估CRS下的抑郁相關行為。然后,DSS和DSS+CRS組小鼠飲用2.5% (w/v) DSS 7天。在DSS給藥后第8天,對所有實驗組的小鼠進行安樂死以評估小鼠結腸長度和組織學評分。DSS+CRS組中的兩只小鼠因嚴重的結腸炎在DSS給藥期間導致意外死亡而從實驗中移除。
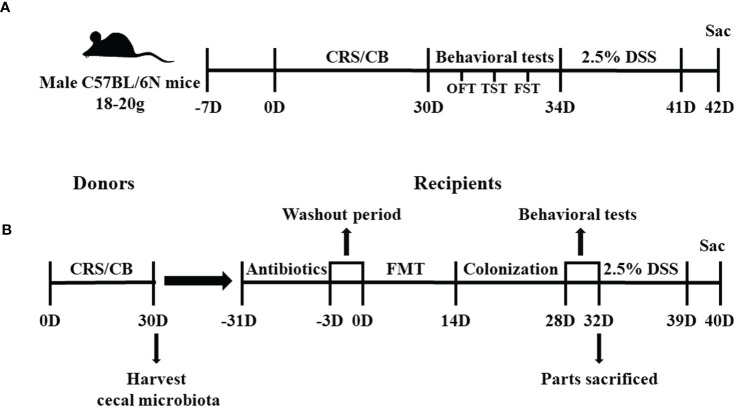
圖 實驗1和2的研究時間線
實驗2:腸道微生物群移植和定植
72只小鼠被隨機分配到八組:供體CB(N = 10)、供體CRS(N = 20)、受體-CB(RE-CB, n = 6)、受體-CRS(RE-CRS, N = 6)、受體CRS-Akkermansia muciniphila(RE-CRS-AKK, n = 6), 受體-CB-DSS(RE-CB-DSS, N = 8), 受體-CRS-DSS(RE-CRS-DSS, n = 8), 受體CRS-Akkermansia muciniphila-DSS(RE-CRS-AKK-DSS,N = 8)。將供體CRS組中的小鼠每天限制在離心管中3小時,連續30天。供體組中的所有小鼠在第31天被安樂死以收集盲腸微生物內容物用于糞便微生物群移植(FMT)。基于活動組(供體CB小鼠或供體CRS小鼠)將來自供體組的盲腸內容物混合一起至50 ml離心管中制成凍融懸液。接受組的小鼠在FMT前持續30天隨意服用以下抗生素混合物:氨芐青霉素、新霉素、甲硝唑(均為1克/毫升)和萬古霉素(0.5克/毫升),以耗盡所有腸道微生物群。在3天的洗脫期后,然后將100 μl凍融懸液通過口服管飼法給予每只受體小鼠,持續14天。此外,用CRS懸液處理的兩個受體組分別口服100 μl含有1×108 CFU的A. muciniphila MucT(DSM 22959)和等體積PBS作為平行對照。在腸道微生物群定植后進行行為測試。在行為測試結束時,一些受體小鼠被安樂死,其他小鼠在飲用水中接受2.5% DSS 7天。收集小鼠結腸進行分析。
研究結果
實驗一:CRS造成不良心理影響、結腸炎加重、微生物群失調
CRS誘發抑郁樣行為和嚴重結腸炎。CRS動物模型在DSS給藥前表現出抑郁樣行為。與CB組相比,CRS小鼠在OFT中的運動距離顯著縮短。此外,與CB組相比,在CRS條件下的小鼠中觀察到不動性增加和游泳時間減少。在DSS暴露7天后,CRS小鼠出現嚴重的結腸炎,其特征是血性腹瀉、炎癥細胞嚴重浸潤、腸壁廣泛的絨毛損傷和反應性上皮細胞增生。DSS+CRS組的結腸長度短于DSS組。此外,DSS+CRS組的組織病理學評分高于DSS組。
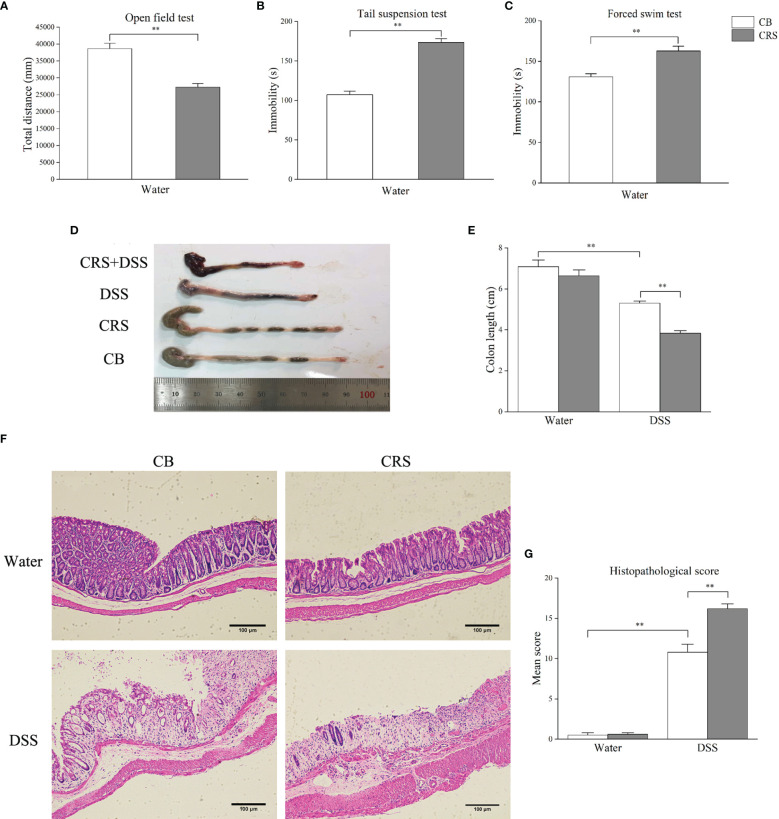
上圖 CRS加重了DSS引起的結腸損傷
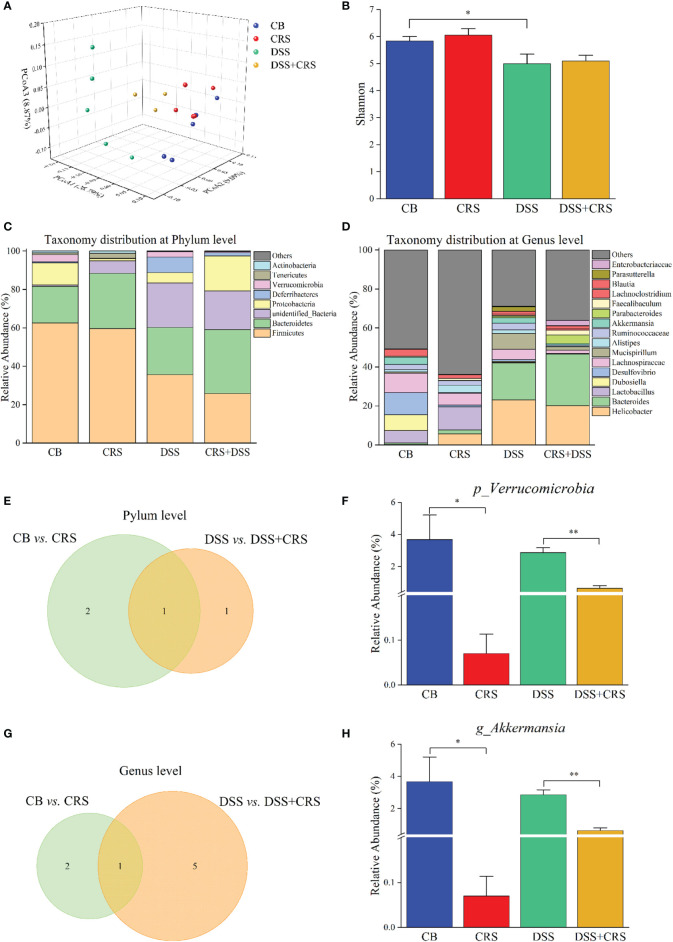
下圖 在CRS小鼠中觀察到A. muciniphila減少
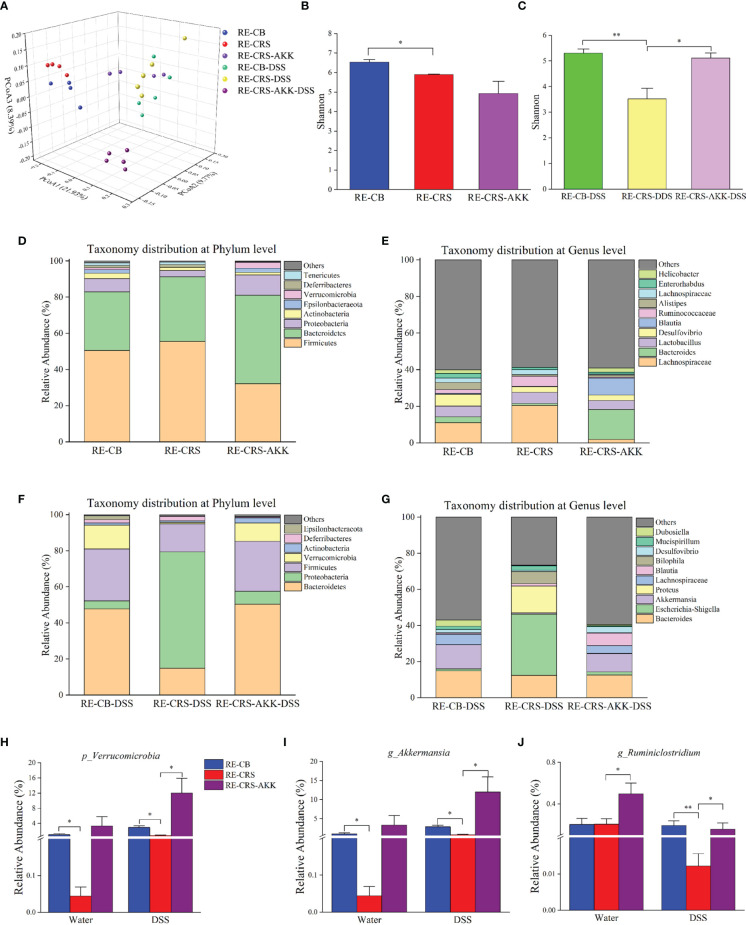
A. muciniphila豐度在CRS小鼠中減少。利用16S rRNA測序來量化和表征CRS條件下小鼠的腸道微生物群,結果發現,與CB組相比,DSS組的香農指數下降,但從CB vs CRS和DSS vs DSS+CRS的比較中沒有觀察到alpha多樣性的差異。未加權的UniFrac PCoA分析表明四組之間OTU水平的beta多樣性存在明顯差異。與CB組相比,CRS組小鼠的微生物組表現出基于ANOSIM值的顯著變化。然而,當比較DSS組與DSS+CRS組時并沒有發現差異。接下來分析每組的微生物群落結構發現,在門和屬水平上,CRS組或DSS+CRS組的微生物群組成發生了顯著變化。在門水平上,分別從CB vs CRS、DSS vs DSS+CRS的比較中確定了三個和兩個優勢門。與CB組相比,CRS組中變形菌門和疣微菌門的相對豐度降低,而黑色素桿菌門的相對豐度增加。CRS+DS組中變形菌門的相對豐度高于DSS組,疣微菌門相對豐度降低。在門水平上,疣微菌的相對豐度在兩個比較中都顯著降低。在屬水平上,與CB組相比,CRS組中Odoribacter屬的相對豐度增加,Akkermansia和Desulfovibrio屬的相對豐度降低。此外,與DSS組相比,DSS+CRS組中Erysipelatoclostridium、Enterococcus、Parabacteroides屬的比例顯著增加,而Romboutsia、Dubosiella和Akkermansia屬的比例減少。在門水平上,兩個比較中接受CRS的小鼠表現出Akkermansia屬豐度減少。
患有抑郁癥的UC患者中A. muciniphila的患病率。為評估患有抑郁癥的UC患者中A. muciniphila的患病率,從16名患有抑郁癥的UC患者和19名UC患者中收集了總共35份糞便樣本作為對照。實時 PCR數據進一步證實了患有抑郁癥的 UC患者中A. muciniphila的豐度降低。最重要的是,這些結果表明CRS下較低豐度的A. muciniphila可能與結腸炎的加重有關。
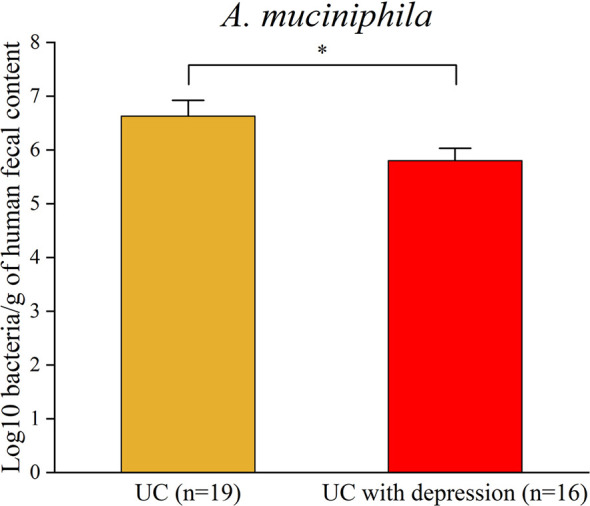

上圖 實時 PCR分析證實患有抑郁癥的UC患者中A. muciniphila的減少
下圖 高通量RNA-Seq分析CRS下的DEG
CRS調控的差異表達基因與小鼠A. muciniphila的相互作用。為確定CRS如何在DSS誘導的結腸炎中發揮有害作用,該研究通過CB vs CRS以及DSS vs DSS+CRS的比較在小鼠結腸組織中進行了DEG分析,分別鑒定了3,523和2,621個DEGs。值得注意的是,在兩次比較中,69個DEGs發生顯著變化。當將CB與CRS小鼠進行比較時,10個最重要的GO terms表明CRS主要控制核糖體的結構成分、轉錄共調節活性和酶激活銀子活性,KEGG通路分析表明CRS主要調節阿爾茨海默病、帕金森病和亨廷頓病。當將DSS與DSS+CRS小鼠進行比較時,10個最重要的GO terms表明CRS與受體配體、細胞因子和細胞因子受體活性有關,KEGG通路分析顯示10條最富集的通路包括IL-17信號通路、TNF信號通路和Th17細胞分化通路。從上述兩個比較中篩選出69個DEGs,并進行GO和KEGG通路分析,GO分析表明鑒定出的DEGs與脂肪酸結合、長鏈脂肪酸結合和Toll樣受體結合有關;KEGG通路分析顯示DEGs與IL-17、TNF和AMPK信號通路有關。
為驗證宿主基因與改變的微生物群落之間的關系并確定它們在加重結腸炎嚴重程度方面的潛在作用,該研究對CRS和A. muciniphila調控的69個DEGs進行了相關分析,結果顯示34個DEGs與A. muciniphila顯著相關。值得注意的是,MUC2表達與A. muciniphila呈正相關。
CRS抑制結腸中的粘液產生和杯狀細胞數量。進行qRT-PCR以驗證從候選DEG中選擇的MUC2的表達和相關性分析,結果表明CRS降低了MUC2的表達,CRS下小鼠每個絨毛中的MUC2陽性細胞顯著減少。由于杯狀細胞產生粘蛋白,該研究接下來檢查了來自不同組的小鼠的結腸,并通過PAS/AB染色計算了杯狀細胞的數量,結果顯示,與非CRS小鼠相比,所有CRS小鼠的杯狀細胞數量顯著減少。

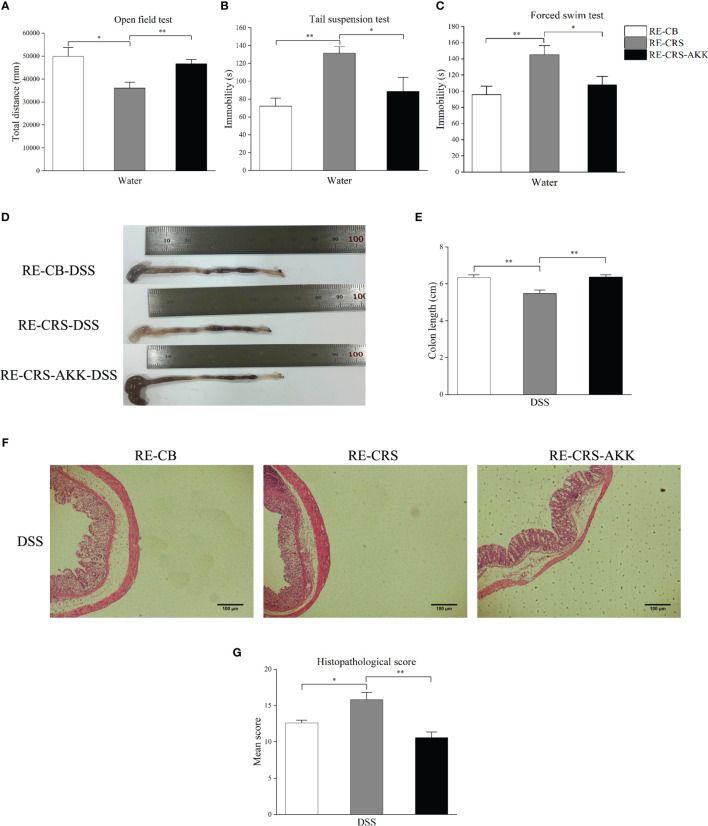
上圖 慢性束縛應激促使結腸黏膜屏障受損
下圖 補充A. muciniphila減輕了受體小鼠的抑郁樣行為和結腸炎加重
實驗二:補充A. muciniphila能預防粘膜屏障缺陷和結腸炎加重
補充A. muciniphila可減輕受體小鼠的抑郁樣行為和加重結腸炎。為進一步評估CRS驅動的生態失調在與A. muciniphila相關的結腸炎惡化中的作用,該研究在受體小鼠中進行了 FMT。與CB菌群定植的受體小鼠相比,CRS菌群定植的受體小鼠在OFT、TST和FST中表現出更多的抑郁樣行為。與定植CRS微生物群的受體小鼠相比,補充A. muciniphila減輕了抑郁樣行為,包括減少TST和FST的不動時間,以及增加OFT的運動距離。在DSS給藥7天后,與CB微生物群相比,在CRS微生物群定植的受體小鼠中觀察到顯著的嚴重結腸炎。相反,與CRS微生物群定植的受體小鼠相比,補充A. muciniphila增加了結腸長度并降低了組織病理學評分。
補充A. muciniphila抑制受體小鼠結腸粘膜屏障損傷。為闡明腸道微生物群的失調是否是結腸黏膜屏障缺陷的原因,該研究分析了受體小鼠的黏膜屏障功能。定植CRS微生物群的小鼠在DSS暴露前后表現出結腸黏膜屏障破壞,而補充A. muciniphila顯著增強MUC2的表達,并增加每個絨毛中杯狀細胞和MUC2陽性細胞的數量。
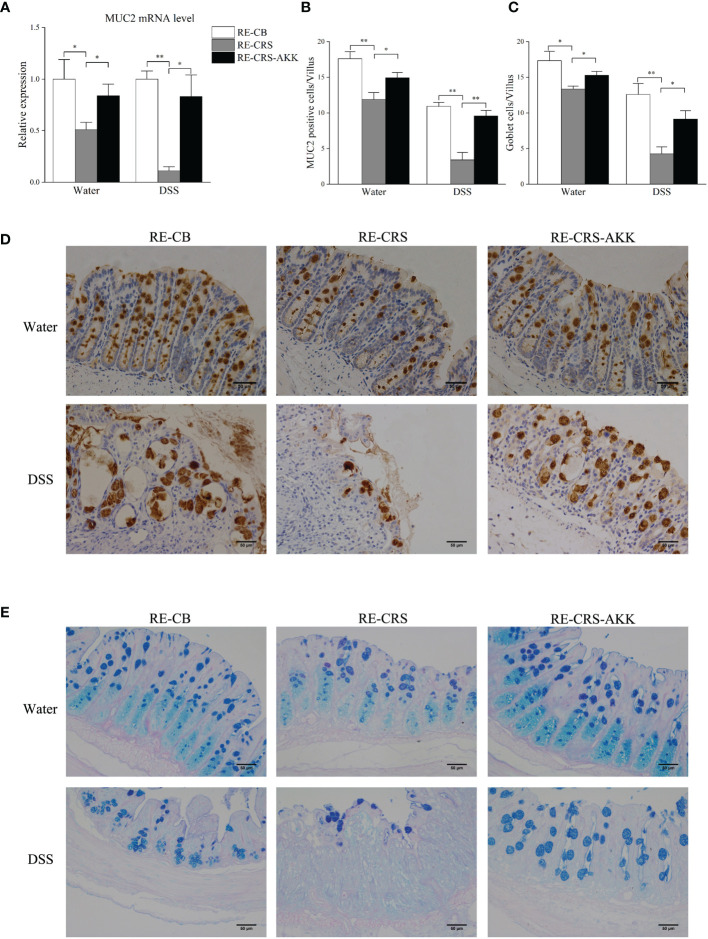
上圖 補充A. muciniphila保護受體小鼠的結腸粘膜缺陷
下圖 補充A. muciniphila重塑了受體小鼠的腸道微生物群
補充A. muciniphila改造了受體小鼠的腸道微生物群。基于16S rRNA 測序,香農多樣性指數顯示,與定植 CRS微生物群的受體小鼠相比,在DSS暴露后補充A. muciniphila增加了α多樣性。此外,與接種CB微生物群的受體小鼠相比,添加A. muciniphila前后的香農多樣性指數沒有顯著差異,表明在A. muciniphila治療后部分恢復了α多樣性。ANOSIM分析表明,與CRS微生物群定植的小鼠相比,在DSS給藥前后,補充A. muciniphila導致不同的腸道微生物群落。與實驗1一致,在DSS給藥前后,CR菌群定植的小鼠中疣微菌門和Akkermansia屬的相對豐度比CB菌群定植的小鼠低。在DSS暴露后補充A. muciniphila顯著增加了疣微菌門和Akkermansia屬的相對豐度。值得注意的是,補充A. muciniphila顯著增強Ruminiclostridium屬的相對豐度。
研究結論
該研究證實了慢性束縛應激(CRS)條件下的小鼠表現出微生物群組成的改變、結腸粘液的破壞和結腸炎的加重。此外,Akkermansia muciniphila的豐度在CRS和UC抑郁癥患者中顯著降低,并與MUC2的表達呈正相關。抗生素處理后定植CRS微生物群的受體小鼠表現出屏障缺陷和嚴重的結腸炎。補充Akkermansia muciniphila可以恢復結腸粘液并改變腸道微生物群。該研究結果表明,A. muciniphila有望成為一種潛在的益生菌,用于保護和治療伴有心理障礙的IBD患者,這些心理障礙與結腸粘液的損傷有關。
研究報告原文詳見

「文章僅供學術探討,如需轉載請注明出處。」
 yzh@akkpro.com
yzh@akkpro.com


