歡迎您訪問愛非克(深圳)生物科技有限公司
關鍵詞:AKK菌
代謝類疾病有多種類型,且疾病負擔較重,已成為制約人類健康預期壽命的重要因素。
隨著經濟發展,人民生活水平的提高,為滿足口腹之欲而攝入許多高糖高脂以及高嘌呤食物明顯增加,不健康的飲食引起腸道不適,繼而深化影響到人體代謝紊亂。近年來,我國代謝性疾病發病率呈上升趨勢,且嚴重影響了人體健康。
研究背景
在過去三十年中代謝性疾病的患病率越來越高。眾所周知,腸道微生物群(包括 Akkermansia muciniphila)可調節人體的能量代謝、葡萄糖耐量、免疫系統成熟和功能。一些研究表明, A. muciniphila豐度與代謝紊亂(如肥胖和2型糖尿病)相關,并且補充活的或巴氏殺菌的A. muciniphila可改善代謝性內毒素血癥并改善腸道屏障功能,從而改善全身代謝。A. muciniphila誘導一種獨特的免疫反應類型,涉及穩態抗原特異性IgG抗體和T細胞反應,以及結直腸癌模型中的細胞毒性T細胞反應。此外,在高脂肪飲食(HFD)喂養的小鼠中,A. muciniphila激活脂肪組織駐留的調節性T細胞,其成分Amuc_1100據報道與Toll樣受體2相互作用。但是,幾乎沒有證據表明涉及A. muciniphila的有益作用的機制,包括特定的宿主細胞成分或細菌蛋白。特別是缺乏對A. muciniphila與宿主脂肪組織庫—包括介導非顫抖產熱的肩胛間棕色脂肪組織(iBAT)—之間關系的研究。腸道微生物群也會影響腸內分泌系統,并通過微生物衍生的代謝物或細胞膜成分調節宿主免疫系統。特別是細菌代謝物,如短鏈脂肪酸(SCFAs)、次級膽汁酸、吲哚和脂多糖,通過刺激腸道激素(如GLP-1)的釋放和通過激活腸道神經元信號傳導來調節食欲,這有助于能量穩態。雖然已知A. muciniphila會影響腸道中釋放腸道激素的L細胞,但缺乏參與GLP-1分泌的A. muciniphila生物活性分子的證據。
研究內容
A. muciniphila菌株的分離和培養:A. muciniphila(ATCC-BAA-835)孵育培養后,從板中收集細菌懸浮在含有甘油的厭氧磷酸鹽緩沖鹽水(PBS)中。每只小鼠口服200μl含4.0×108 CFU A. muciniphila的厭氧PBS懸浮液。A. muciniphila(SNUG-61027)是從前一年未接受抗生素治療的三名健康個體中新鮮收集的糞便樣本中分離出來的,16S-rRNA序列基本局部比對搜索工具分析表明,該分離物與ATCC-BAA-835 100%相似。
動物實驗:C57BL/6J小鼠(SLC)在12/12 h(光/暗)的循環下被安置在無病原體的動物設施中(每個籠子不超過四只),并給予自由獲取食物和水的機會。(1)C57BL/6J雄性小鼠(6周齡)喂食低脂飲食、HFD或喂食HFD并且每天一起施用A. muciniphila,持續14周,每組小鼠為n = 7-10只,將小鼠的體重匹配并隨機分配。每周測量一次食物攝入量和體重。在治療期結束時,對小鼠進行安樂死和分析。(2)C57BL/6J雄性小鼠(6周齡)喂食低脂飲食、HFD或在HFD喂養期間口服(或腹腔)來自A. muciniphila的純化蛋白P9(每只小鼠100μg),每組小鼠n = 8,在8周時對小鼠實施安樂死后進行分析。(3)比較分析P9在IL-6-基因敲除(KO) HFD喂養小鼠和野生型(WT)小鼠中的作用。使用IL-6-KO的C57BL/6J雄性小鼠(6周齡),WT小鼠雄性小鼠(6周齡)作為對照,分為WT:HFD(n = 8)、HFD + P9(n = 8);IL-6-KO:HFD(n=6)、HFD+ P9(n=6)。所有小鼠最初都適應環境1周,同時食用正常飲食,并在相同的條件下在同一設施中飼養。HFD對IL-6-KO和WT小鼠代謝(包括血糖,體重增加和食物攝入)的影響相似。在實驗結束時,用異氟醚麻醉動物,并通過眶后竇穿刺收集血液樣本,然后通過頸椎脫位殺死小鼠。
對小鼠進行葡萄糖和胰島素耐量測試。收集小鼠血漿測量血漿胰島素濃度和血漿GLP-1濃度。用P9(50 μg/ml)處理30分鐘后從NCI-H716細胞中提取RNA進行RNA-seq分析。收集小鼠盲腸進行盲腸代謝物分析和盲腸微生物群的分析。C57BL/6J小鼠喂食60% HFD,并口服施用200 μl P9(每只小鼠100μg)或相同體積的無內毒素蒸餾水10 d。將小鼠單獨放入代謝室(Oxylet系統,Panlab-Harvard設備)中,并在進行測量之前適應2天,然后進行間接量熱法和身體成分測量。
研究結果
與HFD喂養的小鼠相比,口服A. muciniphila(ATCC-BAA-835)顯著降低小鼠體重,改善了葡萄糖耐量,并增加血漿中胰島素和β氧化基因標志物的濃度。有趣的是,A. muciniphila治療的HFD喂養小鼠中iBAT的質量和大小較低,而附睪白色脂肪組織(epWAT)的質量和大小不受A. muciniphila治療的影響。這些結果與最近的發現一致,即給予活的A. muciniphila不影響epWAT脂肪細胞直徑或脂肪量,這表明在A. muciniphila治療后iBAT有特異性損失。接下來通過分析產熱基因轉錄評估iBAT的功能代謝能力。在A. muciniphila治療的HFD喂養小鼠的 iBAT中觀察到編碼解偶聯蛋白1(Ucp1)的線粒體特異性基因和相關產熱分化標記轉錄本的顯著誘導,但在腹股溝WAT(igWAT)中沒有觀察到,這意味著A. muciniphila的抗肥胖作用通過iBAT而不是igWAT起作用。與對照組相比,使用A. muciniphila給藥的HFD喂養小鼠的iBAT皮膚溫度以及直腸溫度顯著更高。此外,在用A. muciniphila給藥的小鼠中,iBAT中抗炎M2巨噬細胞(CD11b + CD206 +)的數量顯著更高。
A. muciniphila和S24-7(也稱為Muribaculaceae)科屬在口服A. muciniphila的小鼠中更豐富。同樣地,A. muciniphila的16S rRNA基因計數與iBAT溫度和血漿GLP-1濃度呈正相關,并且與葡萄糖不耐受水平呈負相關。此外,A. muciniphila給藥小鼠的iBAT中M2巨噬細胞標志物的轉錄本增加。這些結果表明,A. muciniphila影響小鼠iBAT的產熱活性和iBAT特異性M2樣巨噬細胞的豐度。
為評估iBAT中產熱基因上調的潛在機制,該研究比較了口服活的A. muciniphila和對照HFD喂養小鼠之間的盲腸代謝物。與對照組相比,盡管治療小鼠的盲腸內容物中肌酸和甘氨酸的濃度較高,但差異很小。因此,該研究得出結論,A. muciniphila治療對盲腸代謝物沒有重大影響。
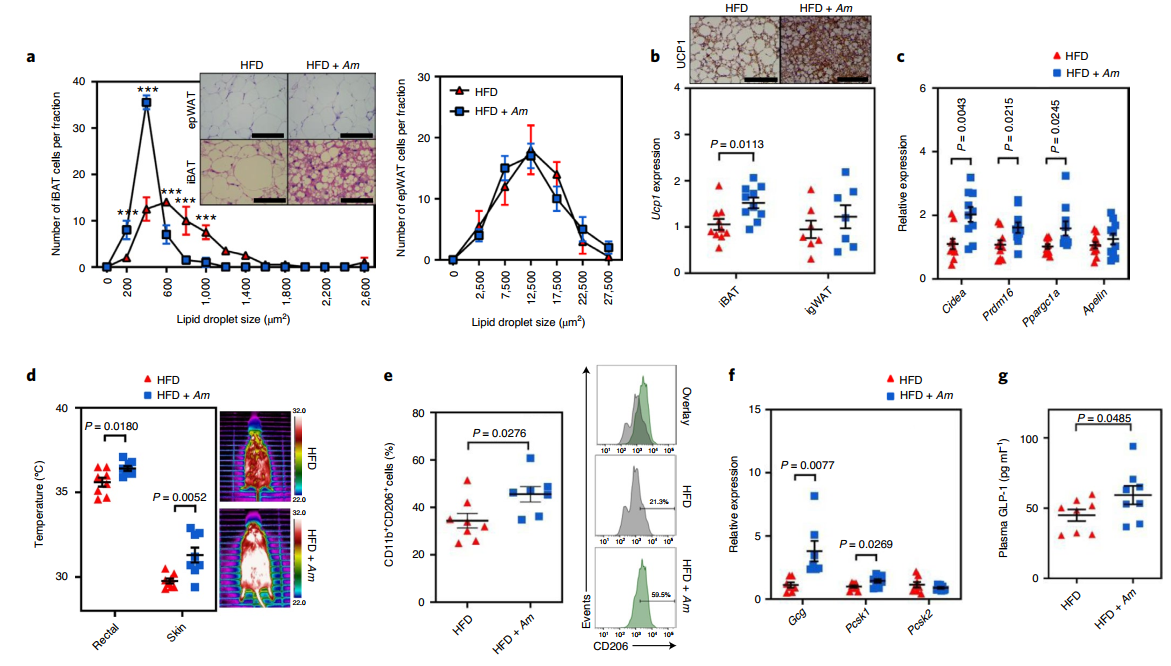
圖 A. muciniphila激活棕色脂肪細胞,誘導GLP-1的表達
GLP-1調節BAT產熱,因此接下來研究了口服A. muciniphila是否會影響培養的L細胞和HFD喂養小鼠中的GLP-1表達。由于大多數分泌GLP-1的L細胞位于回腸遠端,因此測量了口服給藥A. muciniphila后HFD喂養小鼠回腸中的GLP-1表達。在每組小鼠中測量Gcg(編碼GLP-1或胰高血糖素)、Pcsk1和Pcsk2的轉錄。與對照組相比,在用A. muciniphila給藥的HFD喂養小鼠中發現Gcg和Pcsk1的表達要高得多。同樣,與對照組相比,口服A. muciniphila的HFD喂養小鼠的血漿GLP-1濃度更高。
接下來為確定A. muciniphila如何誘導GLP-1分泌,該研究用活的A. muciniphila(SNUG-61027或ATCC-BAA-835)顆粒或細菌懸浮液處理人腸內分泌L細胞(NCI-H716),然后測量GLP-1濃度。結果發現,無細胞上清液(CFS)顯著增加GLP-1濃度,而細菌沉淀則沒有。為確定這種效應是否具有劑量依賴性,該研究用10-100%(v/v)濃度的A. muciniphila CFS處理NCI-H716細胞,發現GLP-1以劑量依賴性方式被誘導。此外也用從人類糞便中分離出的23種乳酸桿菌和24種雙歧桿菌菌株測試NCI-H716細胞分泌GLP-1的影響。ATCC-BAA-835和新分離的SNUG-61027的CFS(10% v/v)強烈誘導GLP-1分泌,而所有47種菌株的CFS均無效果。
由于腸內分泌細胞可以通過增加其GLP-1、乙酸鹽和丙酸鹽的分泌來對SCFAs作出反應,因此將存在于A. muciniphila CFS中這些施用于腸內分泌細胞。然而,雖然GLP-1分泌增加,但其增加幅度不如在CFS中觀察到的增加那么多,這表明SCFAs并不是唯一誘導GLP-1分泌的細菌產物。
為了鑒定負責GLP-1分泌的A. muciniphila其他衍生分子,將培養的A. muciniphila CFS(SNUG-61027)過濾以產生一系列組分。每個組分使用5 mg處理NCI-H716細胞,并測量GLP-1分泌。有趣的是,100-300 kDa濾液顯著增加了GLP-1的分泌,30-100 kDa濾液增加的程度較輕。用蛋白酶K處理消除兩種組分的作用,表明負責誘導GLP-1分泌的一個或多個分子可能是一種蛋白質。為了分離A. muciniphila產生的候選蛋白,將SNUG-61027的100-300 kDa濾液和對照培養基(均含有約25 mg/ml蛋白)通過陰離子交換Mono Q柱,收集的組分用于處理NCI-H716細胞并測量GLP-1濃度。m2-m4級分誘導GLP-1分泌;因此,將這些組分濃縮并施加到尺寸排阻柱上以獲得進一步細分的組分,測試其誘導GLP-1分泌的能力。其中,G17-G20組分誘導L細胞分泌最多的GLP-1。
使用液相色譜法結合串聯質譜法(LC-MS / MS)對這些組分進行進一步分析,以確定負責GLP-1分泌的蛋白質。分析了從尺寸截止過濾的100-300 kDa濾液(樣品1)、離子交換色譜產物(樣品2)和尺寸排阻色譜產物(樣品3)中獲得的約90 μg蛋白質。排除在候選蛋白質列表中存在于基礎培養基中的牛特異性蛋白質,鑒定出98個A. muciniphila衍生蛋白和130個牛特異性蛋白:樣品1中有95個,樣品2中有36個,樣品3中有10個。
為研究A. muciniphila衍生蛋白的作用,該研究克隆了與樣品3(方法)中鑒定的蛋白相對應的cDNA,并測試了每種蛋白在L細胞中誘導GLP-1分泌的能力,使用來自ATCC-BAA-835的外膜蛋白Amuc_1100為對照。使用SDS聚丙烯酰胺凝膠電泳從每個質粒中產出正確大小的單個蛋白質,每種蛋白質的序列與該類型菌株(ATCC-BAA-835)產生的等效蛋白質具有很高的相似性(>98%)。
該研究用表達的9種蛋白質中的每一種處理NCI-H716細胞,發現在NCI-H716細胞中P1(UniProt:B2UKW8)、P5(UniProt:B2URM2)和P9(UniProt:B2UM07)以劑量依賴性方式誘導GLP-1。然而,與P9相比,Amuc_1100誘導GLP-1分泌的作用可以忽略不計。在人類原代腸上皮細胞中也證實P9誘導GLP-1。為確定這些影響是否也存在于喂食正常飲食的小鼠中,每天腹腔注射每種蛋白質2周,并比較其體重增加和葡萄糖耐量。在用P9治療的小鼠中顯示出顯著的體重減輕和葡萄糖不耐受的降低,與其他蛋白質的作用相反。此外,為驗證來自其他腸道細菌的與P9同源的克隆蛋白是否具有與P9相似的作用,并且P9屬于肽酶S41A家族,該研究從大腸桿菌(EcPrc)克隆了與P9等效的S41成員,并將其在NCI-H716細胞中誘導GLP-1的能力與來自A. muciniphila的P9的能力進行比較。有趣的是,在L細胞中來自A. muciniphila的P9誘導了GLP-1,但EcPrc沒有,這表明A. muciniphila衍生的P9對GLP-1的分泌具有特異性作用。
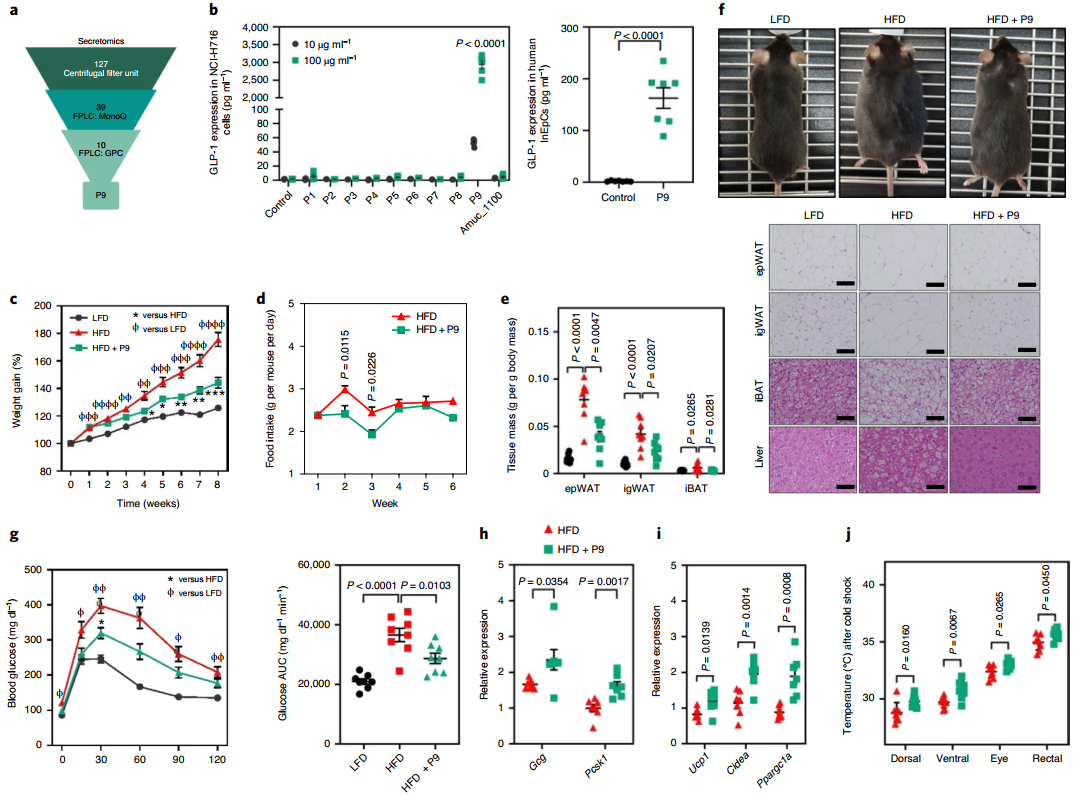
圖 一種從A. muciniphila中純化的GLP-1誘導蛋白P9,通過促進產熱作用來改善肥胖并影響葡萄糖穩態
該研究還比較了小鼠中P9與已酸鹽和丙酸鹽對GLP-1分泌的影響。單次腹腔注射P9誘導高水平的GLP-1分泌,而小鼠中腹腔注射SCFAs或EcPrc則沒有,這表明與其他GLP-1誘導劑(如體內SCFAs)相比,A. muciniphila衍生的P9通過不同的機制誘導GLP-1。
在持續8周每天口服P9的HFD喂養小鼠中也獲得了一致的結果—與對照組相比,喂食P9的小鼠顯示出體重增加和食物攝入量顯著降低。小鼠的脂肪組織體積和葡萄糖耐受也顯著降低,而回腸中GCg和Pcsk1的表達顯著較高。此外,P9誘導產熱,室溫和冷休克后BAT特異性基因的表達以及體溫顯著增加。身體成分分析顯示,瘦體重和脂肪量明顯較高。此外,間接量熱法顯示,用P9給藥的小鼠具有較低的呼吸商和較高的脂肪酸氧化,盡管在能量消耗方面沒有任何差異。總的來說,這些結果表明P9的施用通過調節葡萄糖穩態和通過iBAT誘導產熱來預防肥胖。
接下來為確定P9如何誘導更高的GLP-1表達,RNA測序(RNA-seq)分析P9處理的NCI-H716和對照細胞。值得注意的是,P9誘導編碼鈣相關信號蛋白的基因表達。此外,磷酸激酶測定發現P9增加了磷酸化cAMP反應元件結合蛋白(p-CREB)和磷酸化熱休克蛋白27(p-HSP27)的表達。鈣流入量顯著升高,鈣抑制劑預處理降低了P9誘導的GLP-1表達。
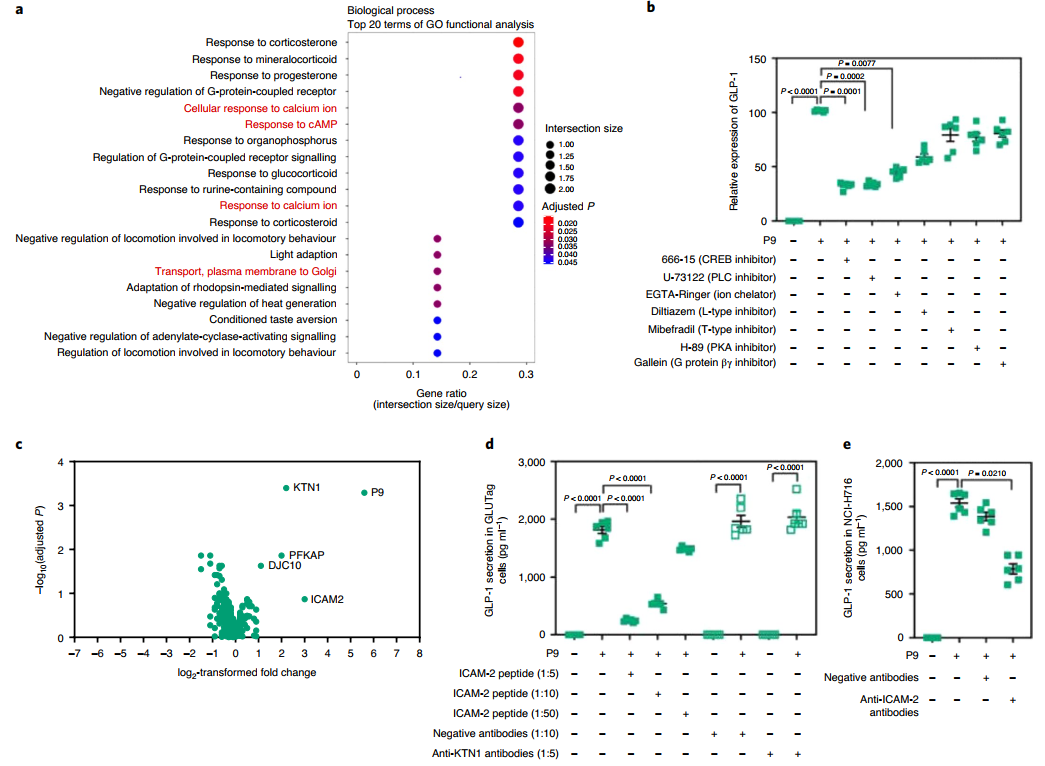
圖 P9通過Ca2 +依賴途徑和iCaM-2誘導GLP-1分泌
GLP-1受體β-抑制蛋白測定證實P9不與GLP-1受體結合。此外,G蛋白偶聯受體(GPCR)組胺H1受體、α-1β腎上腺素能受體和毒蕈堿乙酰膽堿受體M1的抑制劑預處理未改變P9處理后L細胞的GLP-1分泌。為了鑒定P9的受體,該研究使用配體—受體捕獲(LRC)-TriCEPS技術進行蛋白質結合測定,使用LC-MS/MS鑒定NCI-H716細胞中與P9結合的細胞蛋白。富集度最高的P9結合蛋白是驅動結合蛋白1(KTN1),富集度最高的蛋白質是ICAM-2。因此用ICAM-2肽、抗ICAM-2或抗-KTN1抗體預處理細胞,并測量P9誘導的GLP-1分泌。有趣的是,ICAM-2肽以劑量依賴性方式顯著降低了P9誘導的GLP-1分泌。接下來為確定與ICAM-2相互作用的重要性,使用抗-ICAM-2抗體預處理細胞并測量P9的作用。通過這種方式GLP-1的分泌顯著減少,然而,抑制水平不足以阻止ICAM-2的整個效果。這些結果表明,P9直接與ICAM-2結合。
據報道,運動誘導的白細胞介素-6(IL-6)分泌增加刺激腸道L細胞和胰腺α細胞分泌GLP-1,從而促進胰島素分泌。最近,促炎刺激,如內毒素和IL-1β,已被證明以IL-6依賴性方式誘導GLP-1分泌,導致血糖降低。因此,該研究假設P9不僅可能誘導GLP-1,還可能誘導IL-6,IL-6調節葡萄糖穩態。該研究通過實驗發現P9強烈誘導巨噬細胞系中的IL-6表達。還發現A. muciniphila誘導特定的細胞因子表達模式,表現為HFD喂養小鼠的回腸和結腸以及體外巨噬細胞和結腸上皮細胞中IL-6的上調,而不是腫瘤壞死因子α。IL-6增加永生化棕色前脂肪細胞(BCAs)中的產熱基因表達。同樣,IL-6處理從HFD喂養小鼠獲得的原代前脂肪細胞后顯著增加Ucp1的表達。IL-6在GLUTag細胞中誘導GLP-1,盡管與P9處理組相比程度較小,并且與P9處理組相比,P9和IL-6處理后觀察到GLP-1分泌的累加效應。
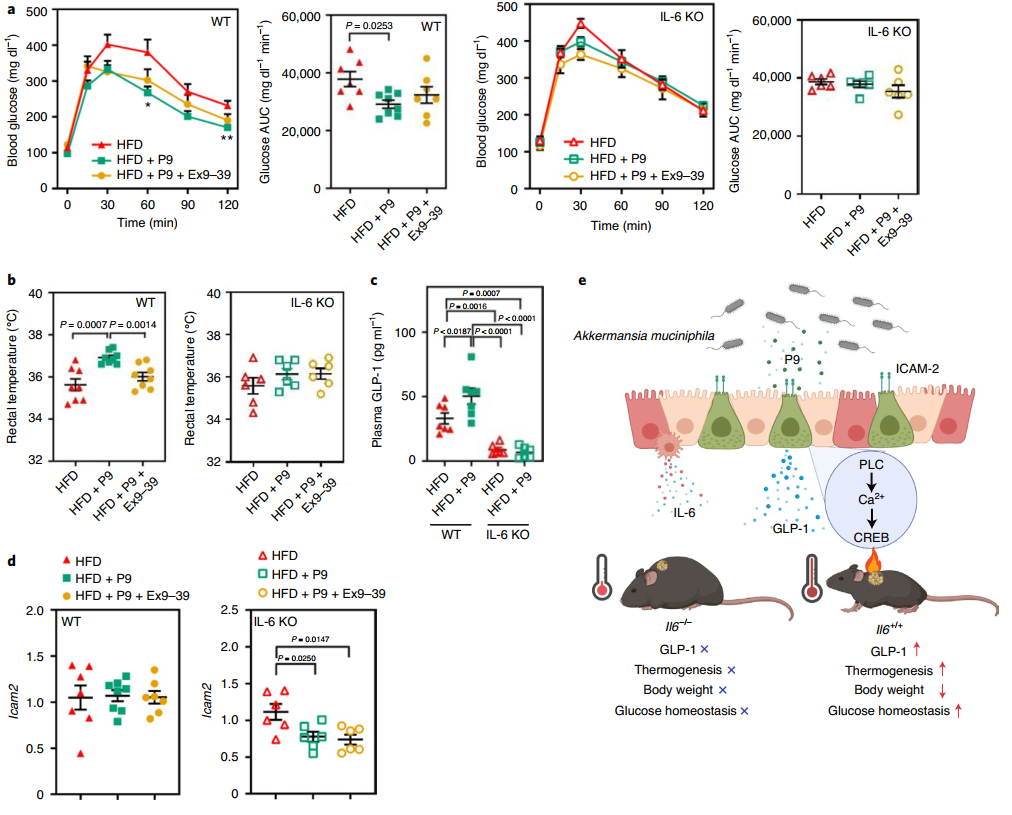
圖 P9通過GLP-1R信號通路和IL-6調節葡萄糖穩態,促進產熱
為確定P9對葡萄糖耐量和肥胖的影響是否通過GLP-1受體(GLP-1R)信號通路以及這些影響是否依賴于IL-6,該研究腹腔注射腸促胰島素類似物(9-39)(GLP-1R拮抗劑)并將P9口服給HFD喂養小鼠,與單獨注射P9的效果進行比較。有趣的是,腸促胰島素類似物(9-39)處理抑制了P9對葡萄糖耐量、胰島素耐量、體重增加和食物攝入的影響,這表明P9激活了GLP-1受體途徑,并介導其對葡萄糖穩態和體重的影響。有趣的是,P9對葡萄糖穩態的影響在IL-6-敲除(KO)小鼠中被完全消除,這意味著IL-6對于P9誘導GLP-1分泌及其對葡萄糖穩態的影響至關重要。雖然單獨使用P9誘導產熱,但腸促胰島素類似物(9-39)的共同注射與室溫和冷休克后的直腸溫度較低有關。此外,在IL-6-KO小鼠中沒有觀察到P9的這些影響,這表明GLP-1R信號傳導和IL-6都參與iBAT激活和產熱。P9處理的野生型(WT)小鼠中循環的GLP-1濃度大大增加,但IL-6-KO小鼠沒有。有趣的是,在IL-6-KO小鼠中Icam2的mRNA表達較低,這表明正常的ICAM-2表達可能需要IL-6。
以前的研究集中在A. muciniphila的外膜上,并表征了79種蛋白質,這些蛋白質可能代表介導與宿主相互作用并具有代謝作用的候選物。比較A. muciniphila外膜的蛋白質與蛋白質組學分析CFS的蛋白質發現只有一種共同的蛋白質(Amuc_0576),這表明A. muciniphila分泌的蛋白質與外膜中存在的蛋白質不同。SNUG-61027和ATCC-BAA-835的9種蛋白的相似度為>98%,P9序列相似度為99.41%。為鑒定人類腸道微生物群中P9或功能相似的肽的同系物,該研究將整個人類腸道宏基因組(GenBank:PPYE01311095.1)與P9序列進行比較,發現99.78%的查詢覆蓋率和100%的序列相似性,表明該蛋白質也存在于人類腸道微生物群中。
討論
參與GPCR信號傳導的受體介導腸內分泌細胞分泌GLP-1。然而,ICAM-2(也稱為CD102)主要被稱為免疫細胞整合素,參與細胞屏障滲透所需的免疫細胞相互作用。該研究提出了ICAM-2的功能,即它充當P9的GPCR樣信號分子,并介導腸內分泌細胞釋放GLP-1。雖然SCFAs被稱為GLP-1誘導劑并且作用于GPCR信號通路,但在該研究中,A. muciniphila產生的乙酸鹽和丙酸鹽不能像P9那樣強烈地誘導GLP-1。這些結果表明,P9通過與SCFAs明顯不同的信號級聯作用于ICAM-2以誘導GLP-1。此外,該發現與細胞內Ca2+信號傳導和CREB和PLC介導途徑的激活介導葡萄糖誘導的GLP-1分泌的概念一致。進一步的研究必須確定ICAM-2如何激活GPCR樣下游信號傳導并誘導GLP-1分泌。
IL-6具有多種組織特異性作用,以旁分泌或內分泌方式實現。IL-6信號傳導的肝臟破壞引起胰島素抵抗,而BAT衍生的IL-6是BAT移植對葡萄糖穩態的影響所必需的。最近的研究表明,急性運動誘導的IL-6增加會延遲胃排空,從而減少人類餐后胰島素分泌。根據先前的研究結果,A. muciniphila在人源性外周血單核細胞中誘導更高的IL-6表達,并且A. muciniphila衍生的細胞外囊泡以劑量依賴性方式誘導IL-6,這里A. muciniphila從腸道通過P9誘導IL-6分泌,這對代謝穩態具有有益作用。此外,P9由A. muciniphila產生,其代謝作用通過IL-6起作用。當GLP-1R或IL-6信號傳導受到抑制時,宿主產熱被阻止。這些結果表明,P9直接參與A. muciniphila對IL-6和GLP-1信號傳導的影響。
盡管P9具有積極作用,但如果A. muciniphila不能在體內超過其他細菌,那么在HFD的惡劣生態競爭條件下維持P9可能具有挑戰性。在人類中,GLP-1在2分鐘內被主動降解,為了規避這一限制,許多研究都集中在開發合成的GLP-1激動劑上,這些激動劑對二肽基肽酶4抑制劑的降解具有抗性。目前,GLP-1受體激動劑被推薦作為二甲雙胍的附加療法,用于2型糖尿病患者,可用作不能耐受二甲雙胍患者的單藥治療。然而,每日皮下注射 GLP-1 激動劑與一些不良反應有關,包括惡心、嘔吐、腹瀉和其他胃腸道癥狀。該研究發現口服P9在小鼠體內顯著改善了葡萄糖穩態。目前正在研究該蛋白質的結構及其在潛在治療用途方面的安全性。
結論
A. muciniphila 通過在棕色脂肪組織和全身誘導解偶聯蛋白1增加高脂肪飲食(HFD)誘導的 C57BL/6J 小鼠的產熱和胰高血糖素樣肽1(GLP-1)的分泌。應用快速蛋白質液相色譜和液相色譜結合質譜分析鑒定出一種84 kDa蛋白質,命名為P9,它由A. muciniphila分泌。通過L細胞和喂食HFD的小鼠實驗表明,單獨純化的P9足以誘導GLP-1分泌和棕色脂肪組織產熱。使用配體-受體捕獲分析發現P9與細胞間黏附分子2(ICAM-2)相互作用。白細胞介素6缺乏會消除P9在葡萄糖穩態中的作用并下調ICAM-2表達。總之,該研究結果表明,P9和ICAM-2之間的相互作用可以作為代謝疾病治療的目標。
「文章僅供學術探討,如需轉載請注明出處。」
 yzh@akkpro.com
yzh@akkpro.com


